曝气是污水好氧生化处理系统的一个重要工艺 环节,它的作用是向反应器内充氧,保证微生物生化 作用所需之溶解氧,并保持反应器内微生物&O5380;底物&O5380;溶解氧,即泥&O5380;水&O5380;气三相的充分混合,为微生物降解 有机物提供有利的生化反应条件〔1〕&O5377;影响城市污水曝气处理效果的因素很多, 其中氧转移速率是一个 关键因素&O5377;氧总转移系数KLa 与温度&O5380;水质&O5380;气液界面的面积等多种因素有关〔2〕&O5377;孙从军等〔3〕研究了水温 对氧转移速率的影响;汤利华等〔4〕研究了水深对曝 气过程中氧总转移系数的影响;张炎等〔5〕研究了气 泡大小对反应器内氧传递系数的影响; 赵静野等〔6〕对曝气充氧中氧总传质系数进行了理论分析与实验 研究;陈季华等〔7〕研究了染整废水的氧转移系数值&O5377;但尚未见有污水COD 对氧总转移系数影响的研究 报道&O5377;笔者以某城市污水处理厂的实际污水为试验对象, 研究了污水 在不同COD 下的氧总转移系数KLa及清污修正系数α 和β 值,以期为城市污水处理厂曝气池的设计提供参考&O5377; 1 试验部分 1.1 试验原理 根据Leuis 和Whitman 的双膜理论, 空气中氧向水体中转移的速率可写成下式〔8〕: 
式中:dc/dt———氧转移速率,mg/(L˙min); Cs———饱和溶解氧质量浓度,mg/L; C———曝气池实际溶解氧质量浓度,mg/L; KLa———氧总转移系数,min-1&O5377; 将式(1)积分后得出:ln(Cs-C)=ln Cs-KLa t (2) 从式(2)可知,水中溶解氧浓度C 是曝气时间t的函数&O5377;由测得的饱和溶解氧浓度Cs及相应于每一时刻t 的溶解氧浓度C,绘制曲线ln(Cs-C)-t,求得斜率即为KLa&O5377; 应用公式KLas=KLa(t)˙1.024(20-t) 可将非标准条件下求得的KLa (t)转换成标准条件(20 ℃,0.1 MPa)下的KLas&O5377;同时对测得的Cs进行压力校正&O5377; 为了反映污水中溶解性两亲分子(极性端亲水,非极性端疏水)型有机物对KLas的影响和含盐量对Cs的影响, 污水处理厂在实际工程设计计算时,通常要引入小于1 的α 和β 2 个清污修正系数〔8〕,氧总转移系数修正系数α 是污水KLa与清水KLa的比值,饱和溶解氧修正系数β 是污水溶解氧的饱和浓度Cs与清水溶解氧的饱和浓度Cs之比&O5377; 1.2 试验装置 试验装置(见图1)2 套&O5377;该装置由有机玻璃柱&O5380;哈希SC100 型在线溶解氧测定仪(2 个探头)&O5380;无油静音空压机&O5380;曝气盘&O5380;循环泵&O5380;流量计组成&O5377;其中2根玻璃柱水位高4 m(模拟该厂曝气池水深), 内径0.23 m,单个反应柱面积0.042 m2,体积0.166 m3;流量计流量范围为0.4~4 m3/h; 曝气膜( 橡胶) 内径6 cm;循环泵流量2 m3/h,扬程10 m&O5377;所用流量计&O5380;气压表&O5380;温度计和秒表等均经过校正&O5377; 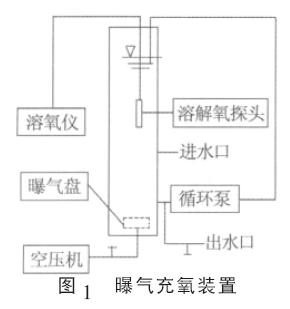
1.3 试验方法 清水氧总转移系数KLa的测量按照CJ/T 3015.2—1993《曝气器清水充氧性能测定》中规定的实验方法和步骤〔9〕进行,即:(1)确定曝气柱内溶解氧测定点位置&O5377;因本试验模型较小,故仅确定一个测定点,将溶解氧测定仪探头置于曝气柱内1/2 处&O5377;(2)向曝气柱内注入自来水, 测量初始状态下水中的溶解氧,计算脱氧剂Na2SO3和催化剂CoCl2的需要量&O5377;(3)将脱氧剂和催化剂溶解后加入到曝气柱,使其迅速扩散&O5377;(4)待溶解氧降到0 时,曝气,每10 s 记录一次溶解氧值,直到饱和为止,并记录试验过程中的气温&O5380;水温&O5380;气压&O5380;气量等数据&O5377;(5)计算清水中氧的总转移系数&O5377; 污水氧总转移系数的测量, 除省去添加脱氧剂和催化剂, 让曝气柱中的污水在曝气过程中自然下降到0 外,其余步骤与清水试验相同&O5377; 2 结果与讨论 2.1 清水中的氧总转移系数 按照上述试验方法, 测定清水中的氧总转移系数,结果见表1&O5377; 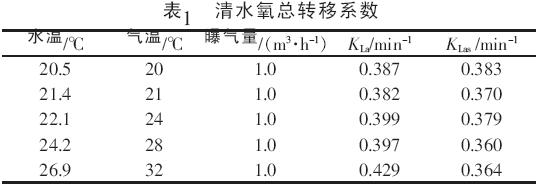
由表1 可见,在曝气量一定的条件下,清水中的氧总转移系数随水温的升高而增大,但增幅不大&O5377;标准状况下KLas的平均值为0.371 2 min-1&O5377; 2.2 污水中的氧总转移系数 按照上述试验方法,测定不同COD 污水中的氧总转移系数,结果见表2&O5377; 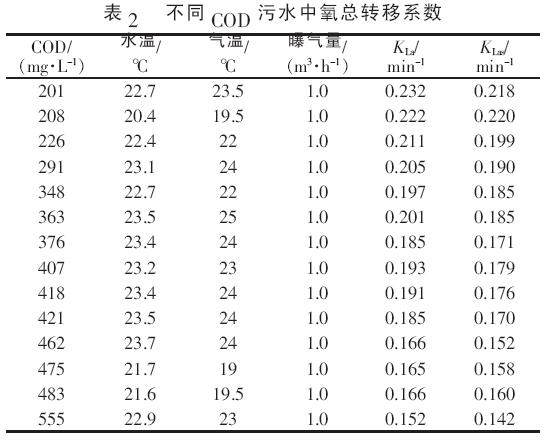
由表2 可看出, 在进水COD 为200~550 mg/L&O5380;曝气量均为1.0 m3/h&O5380;水温基本恒定在(23.5±1) ℃的条件下,氧在污水中的总转移系数KLas具有随污水COD 的升高而降低的趋势, 其平均变化率为-0.018%,说明污水COD 对污水中氧总转移系数有着较大的影响&O5377; 2.3 污水中的清污修正系数α&O5380;β 根据实测的清水与不同COD 污水中KLas和Cs数据, 计算污水中的清污修正系数α&O5380;β, 结果见表3&O5377; 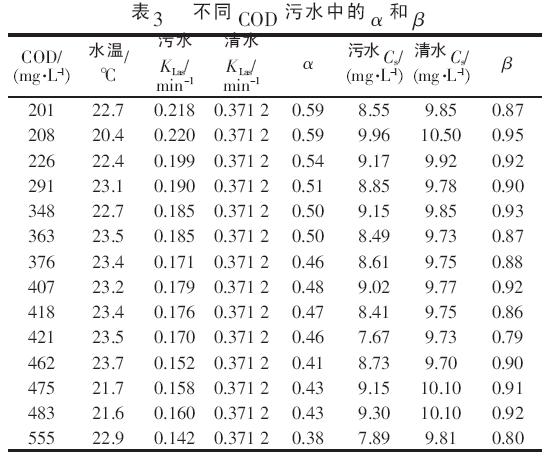
分析表3 结果可知,在水温基本恒定在(23.5±1) ℃, 污水COD 为200~550 mg/L 的条件下,α 随COD 的增加而减小, 当COD<300 mg/L 时,α 均>0.50, 平均值为0.56, 当COD>300 mg/L 时,α 多<0.50,平均值为0.45,说明COD 对α 有较大的影响&O5377;在试验条件下测定得到的α 均在0.6 以下, 其平均值为0.48, 该数值远小于我国现行城镇污水处理厂设计中常采用的α 为0.8~0.85 〔10〕, 但基本与顾夏声〔11〕“对于新鲜生活污水α 为0.26~0.46” 的建议相一致&O5377; 由表3 还可以看到,β 随污水COD 的增加变化不大,其平均值为0.89,该数值与现行城镇污水处理厂设计中建议采用的β 为0.85~0.95〔10〕相吻合,说明在相同的试验条件下改变污水的COD,不会对β 产生影响&O5377;具体参见http://www.dowater.com更多相关技术文档。 3 结论 在水温为(23.5±1) ℃&O5380;曝气量为1.0 m3/h&O5380;进水COD 为200~550 mg/L 的条件下,氧总转移系数KLas随污水COD 的升高而降低, 其平均变化率为-0.018%;氧总转移系数的修正系数α 随COD 的增加而减小,其平均值为0.48;饱和溶解氧的清污修正系数β 随COD 的增加变化不大,其平均值为0.89&O5377;
不同NH4+浓度下SBR系统N2O排放研究 来源:中国污水处理工程网 N2O 是强力温室气体, 其温室效应是CO2的200~300 倍&O5377;据统计,全球每年在污水处理过程中排放的N2O 为0.3×1012~3.0×1012 kg, 占全球N2O 排放总量的2.5% ~25%〔1〕&O5377;由于污水处理的多样性和复杂性,有效控制污水处理过程中N2O 的排放任重而道远&O5377; 污水脱氮中的N2O 排放是微生物与其周围环境共同作用的结果, 环境条件和微生物之间是内外因关系,环境因素通过微生物影响N2O 排放&O5377;研究表明,参与污水脱氮的微生物(如硝化菌&O5380;反硝化菌等)在N2O 的产生能力上存在较大差异〔2-3〕&O5377;如果某污水脱氮系统中微生物群落由N2O 产生能力强的菌组成,那么该系统的N2O 排放量就可能高,反之亦然&O5377;这是污水脱氮中微生物群落影响N2O 排放的可能途径&O5377;近年来, 为了有效控制污水脱氮中N2O的排放,国内外学者围绕pH&O5380;DO&O5380;C/N&O5380;泥龄&O5380;底物浓度等不同环境因素对N2O 排放的影响进行了一些研究〔4-5〕&O5377;但迄今为止,很少涉及到污水脱氮中微生物群落对N2O 排放的影响&O5377; 笔者在不同NH4+浓度下研究了系统氮素转化效率与微生物群落对N2O 排放的影响,以期为有效控制污水处理中N2O 的排放提供参考&O5377; 1 材料与方法 1.1 实验装置及工艺 实验采用内径260 mm&O5380;高360 mm 的圆柱形SBR 反应器,其有效容积为15 L&O5377;以黏砂块作为微孔曝气器, 采用鼓风曝气, 以转子流量计控制曝气量&O5377; 1.2 种子污泥及实验用水 种子污泥取自当地某制药厂污水处理池&O5377;研究采用模拟污水, 模拟污水由葡萄糖&O5380;(NH4)2SO4&O5380;NaHCO3&O5380;NaCl&O5380;CaCl2&O5380;KH2PO4&O5380;MgSO4˙7H2O 配制而成&O5377;模拟污水的pH 为7 左右, 反应过程中不再调pH&O5377; 1.3 污泥驯化及实验方法 将2 000 mg/L 的种子污泥置于SBR 反应器,在室温条件下进行驯化, 实验期间水温为25~28 ℃&O5377;SBR 系统的实验工序为瞬时进水0.5 h&O5380;曝气搅拌5 h&O5380;缺氧搅拌2 h&O5380;沉淀排水1 h 及闲置,每天运行1~2 个周期&O5377;曝气阶段的曝气强度为2.5 L/min&O5377;污泥驯化阶段,好氧硝化段进水NH4+为40 mg/L,COD 为400 mg/L,缺氧反硝化段补充加入COD 200 mg/L&O5377;经过40 d 左右的驯化,当污泥质量浓度达到4 000mg/L 左右, 总氮和COD 去除率稳定达到95%以上时,认为污泥驯化结束&O5377; 当系统稳定运行时,在NH4+质量浓度为20&O5380;40&O5380;60 mg/L 的条件下, 分析了氮素转化过程中的N2O排放及微生物群落特征&O5377;其他条件和污泥驯化时的工艺条件相同&O5377; 1.4 反应气采集及N2O浓度测定 SBR 工艺曝气阶段, 从气体排放口中直接采集反应气;缺氧反硝化段,以吹出的方式采集反应器中液体表面的反应气&O5377; 气样中N2O 的浓度用气相色谱仪电子捕获检测器(ECD)进行检测&O5377;检测条件:柱温40 ℃&O5380;进样口温度60 ℃&O5380;检测器温度330 ℃,柱子采用Porapak Q毛细管柱, 载气为纯氮&O5377;实验中,N2O 标准气(5.27μmol/mol)由南京麦克斯公司提供&O5377; 1.5 其他化学指标分析 污水COD&O5380;NH4+-N&O5380;NO3--N&O5380;NO2--N 等指标的测定采用国家环境保护总局发布的标准方法〔6 〕&O5377;1.6 微生物群落分析实验采用PCR-DGGE(Polymerase Chain Reaction-Denaturing Gradient Gel Electrophoreses)方法,分析不同NH4+-N 浓度下的微生物群落特征&O5377;污泥样品前处理&O5380;总DNA 提取及纯化按文献〔7〕的方法进行&O5377;使用通用引物P2(5’-ATTACCGCGGCTGCTGG-3’) 和P3 (5’ -CGCCCGCCGCGCGCGGCGGGGGGGGGGGCACGGGGGGCCTACGGGAGGCAGCG-Ag-3’)扩增基因组总DNA 16S rDNA V3 区,PC 扩增体系和程序见文献〔8〕&O5377;聚丙烯酰胺的变性梯度范围为35%~60%,DNA 扩增产物上样量为200 ng 左右&O5377;200 V 电压下,1×TAE 缓冲液中电泳240 min&O5377;电泳完毕后,用0.5 mg/L 的溴化乙锭染色,上UVI 成像系统成像&O5377;所得图像用BIO-RAD QUANTITYONE 4.0 软件进行分析&O5377; 2 结果与分析 2.1 氮素转化与N2O 排放 不同NH4+浓度下SBR 系统中的总氮变化如图1 所示&O5377; 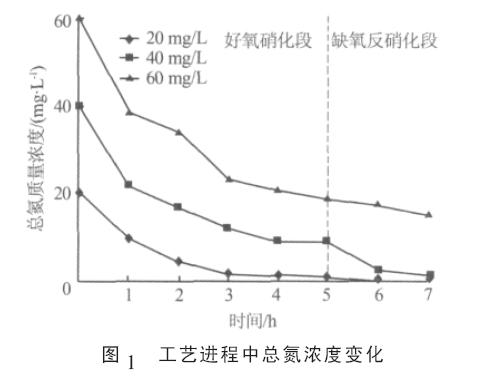
由图1 可见, 当NH4+质量浓度为20&O5380;40 mg/L时,总氮被有效去除,总氮去除时期分别为第3 小时和第7 小时;而当NH4+质量浓度为60 mg/L 时,在整个脱氮周期内总氮去除率只有75%左右&O5377; 工艺进程中SBR 系统的N2O 排放情况如图2所示&O5377; 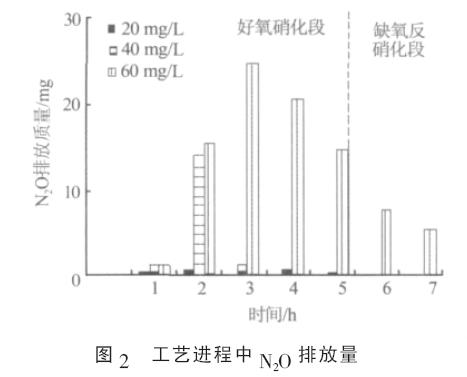
由图2 可见,不同NH4+浓度下SBR 系统的N2O排放量有明显差异&O5377;如在一个脱氮周期内,当NH4+质量浓度分别为20&O5380;40&O5380;60 mg/L 时,N2O 排放量分别为1.16&O5380;17.33&O5380;89.85 mg&O5377; 分析发现, SBR 系统中NH4+转化速率与脱氮中N2O-N 所占的比例呈负相关&O5377;如当NH4+质量浓度为20 mg/L 时, 系统运行至第2 小时时NH4+全部转化( 见图3), 此时系统脱氮中N2O-N 所占比例为0.25%; 当NH4+质量浓度为40 mg/L 时, 系统中的NH4+到第3 小时时全部转化, 和20 mg/L 时相比,NH4+转化时期推迟1 h, 此时系统脱氮中N2O-N 所占比例为1.84%;而当NH4+质量浓度为60 mg/L 时,NH4+的转化明显受到抑制,此时SBR 系统N2O 排放迅速增加(见图2),脱氮中N2O-N 所占比例上升至6.35%&O5377;实验中,随着NH4+浓度的提高,系统脱氮中N2O-N 所占比例最大相差25 倍之多&O5377; 2.2 N2O 排放时期实验中, 在SBR 工艺的好氧硝化段, NH4+转化的同时总氮也呈下降趋势(见图1&O5380;图3),表明在好氧硝化段发生了同时硝化反硝化脱氮作用(SND)&O5377;在一个脱氮周期内,当SBR 系统硝化反硝化作用顺利进行&O5380;系统有效脱氮时,系统N2O 排放时期主要在好氧硝化段的同时硝化反硝化阶段(见图2)&O5377;如本实验中,当NH4+质量浓度为20&O5380;40 mg/L 时,系统同时硝化反硝化阶段分别在0~2 h 和0~3 h(见图1&O5380;图3),在此阶段系统排放的N2O 占总N2O 排放量的95%以上&O5377;而当系统氮素转化明显受到抑制时(见图3),如当NH4+质量浓度为60 mg/L 时,不仅同时硝化反硝化过程中大量排放N2O, 而且缺氧反硝化段也有可观的N2O 排放(见图2)&O5377; 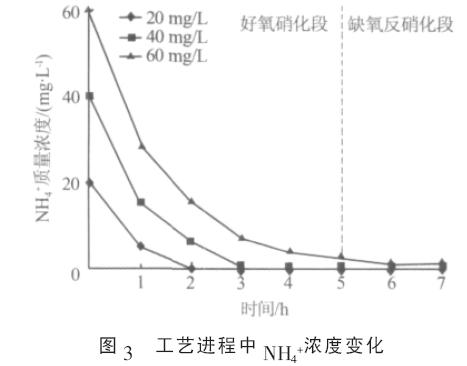
2.3 微生物群落特征 采用PCR-DGGE 技术, 分析了不同NH4+浓度下的微生物群落特征, 结果如图4 所示&O5377;泳道1 和2&O5380;3 和4&O5380;5 和6 分别是NH4+质量浓度为20&O5380;40&O5380;60mg/L 时好氧硝化段和缺氧反硝化段的污泥样&O5377; 
由图4 可知, 每个条带代表一个可能的细菌类群或可操作分类单位(OTU), 条带数越多说明生物多样性越丰富, 条带染色后的荧光强度则反映该细菌的丰富度&O5377;分析发现,不同NH4+浓度下条带分布不尽相同, 如条带a~d 是NH4+质量浓度为20&O5380;40mg/L 时所共有的条带, 当NH4+质量浓度提高到60mg/L 时,这些条带消失或明显减弱;条带e 和h 是NH4+质量浓度为60 mg/L 时特有的条带;条带f&O5380;g 和i 是不同NH4+浓度下所共有的条带等&O5377;实验结果表明,随着NH4+浓度的提高,系统中微生物群落结构发生了相应变化&O5377; 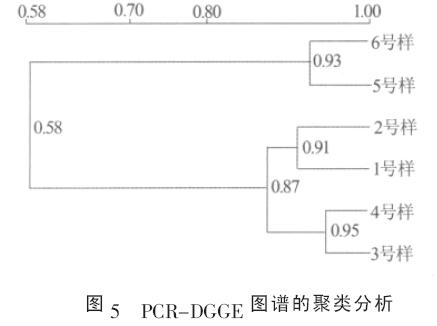
采用BIO-RAD QUANTITY ONE 4.0 软件, 对PCR-DGGE 图谱中微生物群落的相似性进行了UPGMA 聚类分析,见图5&O5377;其中1 和2&O5380;3 和4&O5380;5 和6 号样分别是NH4+质量浓度为20&O5380;40&O5380;60 mg/L 时好氧硝化段和缺氧反硝化段的污泥样&O5377;相似性系数(Cs)为: Cs=2j/(a+b) 式中:a&O5380;b———分别为DGGE 图谱中相比较2 个泳道的条带数目; &O5380;j———共有的条带数目&O5377; Cs 越大,表示微生物群落的相似性就越高&O5377;结果发现:(1)在相同的NH4+浓度条件下,好氧硝化段和缺氧反硝化段微生物群落的相似性均在0.9 以上,表明在一个脱氮周期内的SBR 工艺的不同阶段(好氧硝化和缺氧反硝化段),微生物群落较为稳定;(2) 从不同NH4+浓度下的微生物群落特征来看,NH4+质量浓度从20 mg/L 提高到40 mg/L 时,SBR 系统微生物群落的相似性为0.87,当NH4+质量浓度进一步提高到60 mg/L 时, 和前2 个NH4+浓度下(20&O5380;40 mg/L)的微生物群落相比,其相似性下降到0.58,表明NH4+质量浓度为20&O5380;40 mg/L 下的微生物群落相似性较高,但和NH4+质量浓度为60 mg/L 相比,微生物群落发生明显差异&O5377; 实验中,NH4+质量浓度从20 mg/L 提高到40mg/L 时,SBR 系统微生物群落较为稳定(Cs 为0.87),认为此时系统N2O 排放主要受到氮素转化的影响;当NH4+质量浓度进一步提高到60 mg/L 时,系统微生物群落发生明显变化(Cs 为0.58),认为此时污水脱氮中N2O 排放不仅受到氮素转化的影响,同时还受到微生物群落变化的影响&O5377;可见,污水处理过程中,当环境条件发生剧烈变化时,微生物群落的变化对N2O 排放的影响值得重视&O5377;具体参见http://www.dowater.com更多相关技术文档。 3 结论 (1)随着NH4+转化效率的下降,SBR 系统脱氮中N2O-N 所占比例增加&O5377;实验中,不同NH4+浓度下,脱氮中N2O-N 所占比例在0.25%~6.35%之间&O5377; (2)SBR 系统中,当氮素转化顺利进行时,N2O排放时期主要局限在好氧硝化段的同时硝化反硝化阶段,而当氮素转化受到抑制时,好氧硝化段和缺氧反硝化段均有大量的N2O 排放&O5377; (3)不同NH4+浓度下,SBR 系统微生物群落发生相应变化&O5377;相同的NH4+浓度下,SBR 系统好氧硝化段和缺氧反硝化段的微生物群落较为稳定&O5377;
|